|
||||
|
|
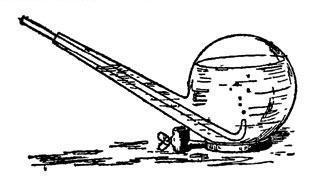
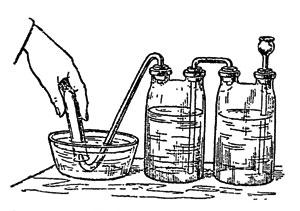
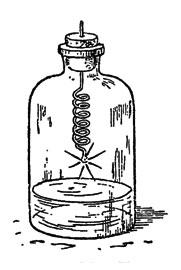
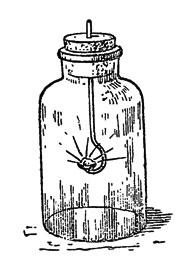
Глава IV. Газ разнообразного применения Это уже отчасти знакомый вам хлор. Выйдемте в сад, и я ближе познакомлю вас с этим газом, так как, добывая его в комнате, мы рискуем очутиться в положении одного химика-дилетанта, который своими опытами переполошил всех жильцов многоэтажного дома. Чтобы самому экспериментатору не стать жертвою газа, лучше, делая опыты, дышать через платок, смоченный раствором гипосульфита натрия. Техники так и зовут его антихлором, применяя для удаления следов хлора из отбеливаемых последним пряжи, тканей и бумажной массы. Вообще, надо заметить, что хлор задолго до использования в военном деле готовился в больших количествах для различных технических целей, а опыт войны привел к применению хлора в земледелии для отравления вредителей растительности. Им же отравляют разносителей чумных бактерий. В виде белильной извести и хлорной воды этот газ является испытанным дезинфекционным средством. Сравнительно недавно медики научились дезинфицировать им живой организм человека. Оказывается, что если вдыхание воздуха, содержащего достаточную примесь хлора, вызывает удушье и даже смерть, то воздух с очень ничтожным содержанием хлора вылечивает от гриппа и других болезней дыхательных путей убивая болезнетворных микробов, но не разрушая тканей организма. Но самое любопытное, что хлор, будучи сам боевым газом, служит средством защиты от действия еще более страшного, чем он, газа иприта (горчичного газа). Иприт - это тоже одно из сложных производных хлора. Не испугайтесь его научного названия: дихлордиэтилсульфид. Химик, впервые его открывший, писал о нем: "Поразительно, как вещество, с виду такое безобидное, мало летучее, почти нерастворимое в воде, с слабым запахом, с совершенно нейтральной реакцией и с химической структурой, при которой совершенно нельзя предполагать столь опасных свойств, - оказывает такое сильное действие". А надо отдать справедливость, действие иприта чрезвычайно сильное. Тяжелые ожоги кожи, трудно заживающие, гноящиеся язвы, гнойное воспаление легких, слепота, бронхит, лихорадка, наконец, смерть - таковы следствия отравления ипритом. Эта маслянистая бесцветная жидкость, разлитая на каком-либо пространстве, может держаться в почве в течение месяцев, все время делая местность необитаемой. Средство его обеззараживания - нейтрализация иприта хлором. Как тут не вспомнить пословицу: "клин клином вышибают!" Попутно скажу, что еще ужаснее иприта другое сложное производное хлора, мышьяка, углерода и водорода - люизит, хотя не испытанный на полях сражения, но практиковавшийся капиталистами для "бескровного" разгона рабочих демонстраций и стачечников. Его называют "смертельной росой". Предполагают, что 50 аэропланов, несущих начиненные люизитом бомбы, могут уничтожить все население Нью-Йорка... Что одно и то же вещество может являться и ядом, и лекарством, химикам давно известно. Например, иприт в определенной дозе и смеси уже испытывался в качестве средства для лечения чахотки. Кто же в наше время не знает, что такие страшные яды, как мышьяк, стрихнин, синильная кислота и прочие, с успехом применяются в медицине? Невинные лавровишневые капли содержат синильную кислоту, одна капля которой, если ее взять в чистом виде, способна умертвить лошадь. Начальник химической службы США сказал, что со времени изобретения пороха ничто не внесло таких изменений в способы ведения войны, как отравляющие вещества. С момента, когда действие этих веществ станет независимо от погоды, методы войны резко изменятся. Одежда бойцов должна стать газонепроницаемой, пища исключительно консервированной в запаянных жестянках, тяга исключительно механической, убежища должны иметь приток кислорода, и пр. и пр. Страшная вещь ураганный артиллерийский обстрел!.. А знаете, какой незначительный эффект он дает в сравнении с количеством выпущенного металла? Вот цифры: длительный обстрел 25000 снарядов дал 2 убитых и 25 раненых, столько же снарядов с отравляющими веществами вывели из строя 300 человек. Трудно, конечно, сказать, какие именно отравляющие вещества путем газовых атак и "химических" бомб, сбрасываемых с аэропланов, применят империалистические державы в подготавливаемых ими войнах. Одно несомненно, - что учиться защите от отравления "военным газом" должен каждый из нас. Вступайте в Осоавиахим, он научит вас практическим мерам борьбы с опасностью отравления. Одна из лучших мер - противогаз, т. е. защитная маска и костюм. Надев их, человек дышит через вещества, связывающие химически отравляющие вещества, следовательно, обезвреживающие их, и тем защищает кожные покровы. Теперь уже выработаны и универсальные противогазы, позволяющие свыше часа оставаться в атмосфере, в которой моментально гибнет всякое живое существо, не снабженное противогазом. Хорошо развитая химическая промышленность и химическая грамотность масс - вот лучшая защита от страшных газов. Окончательно же избавит человечество от них и от войны вообще замена капиталистического строя социалистическим, бесклассовым обществом. Итак, аппарат для получения хлора мною уже собран и готов для обозревания. Он несложен и состоит из колбы с воронкой и газоотводной трубкой, опущенной прямо на дно стеклянного цилиндра для сбора газа. Цилиндр сверху прикрыт куском картона с отверстием для трубки. Хлор в два с половиной раза тяжелее воздуха, так что его можно, в особенности на открытом воздухе, собирать таким упрощенным способом. В воде же он хорошо растворяется, - в холодной лучше, чем в горячей; поэтому, если собирать его под водою, как мы это делали с водородом, то воду надо брать как можно более горячей, хотя при этом трудно избежать лопания сосудов для сбора газа. В колбе находится тесто из перекиси марганца с соляной кислотой. Колба стоит на треножнике, покрытом проволочной асбестированной сеткой (для равномерного нагревания колбы), под которую я поставил спиртовую лампочку. Нагревать надо слегка. Зажигаю спирт, и реакция начинается. Замечаете, как желтеет воздух в колбе? Богатая кислородом перекись марганца[10] отдает его соляной кислоте, отнимая от последней водород. Марганец же в обмене поглощает хлор, обращаясь в хлористый марганец, но так как всего выделяющегося при этом хлора он связать не может, то часть газа остается в свободном состоянии. Этот зеленовато-желтый газ, постепенно вытесняющий воздух из колбы и цилиндра, и есть хлор. Вы, вероятно, уже чувствуете его запах, так как он наполнил сборный сосуд и начал переливаться через край. У меня под рукой несколько таких цилиндров. Заменяю цилиндр, наполненный хлором, новым, а первый прикрываю куском стекла. Хлор и Фарадей Я думаю, что имя Михаила Фарадея вам знакомо? Сын кузнеца, ученик переплетчика, окончивший только начальную школу, он, благодаря выдающемуся уму и любви к знанию, стал основателем всей современной электротехники, открыв "превращение магнетизма в электричество", т. е. возникновение тока в проводнике, движущемся в магнитном поле. Это повело к изобретению динамо-машины, преобразующей механическую энергию в электрический ток высокого напряжения. Но Фарадей, что не все знают, был не только электриком, но и одним из крупнейших химиков своего времени. В частности, он первый доказал, что хлор может быть сгущен в жидкость. Фарадею, когда он работал над сгущением хлора, пришлось выслушать нотацию от одного из ученых, зашедших в лабораторию. - Молодой человек, надо чище мыть химическую посуду, у вас внутри трубки я вижу какие-то жирные капли. Фарадей промолчал, но на другой день послал своему критику записку: "то, что вы сочли грязью, был жидкий хлор". А ученый и не подозревал, что хлор может быть сгущен в жидкость. Хлор, цветы и цвета Сорвите, пожалуйста, вон ту прекрасную розу и пару-другую каких-либо ярко окрашенных цветов. Обрызгиваю их из пульверизатора водой (для растворения хлора) и опускаю в сосуд с хлором. Куда делась их чудная окраска? Смотрите, как они побледнели, какими стали некрасивыми. Бросаю в тот же цилиндр несколько ярких тряпочек, тоже увлажнив их предварительно. Они обесцвечиваются. Во второй цилиндр лью одну за другой жидкости разных цветов, подкрашенные растительными и искусственными органическими красками; туда же вливаю немного чернил из чернильницы и, закрыв отверстие цилиндра стеклом, взбалтываю смесь, пока она не обесцветится. Впрочем, с обесцвечивающей способностью хлора мы с вами уже знакомы: мы пользовались ею в опытах-фокусах, с которых начали нашу беседу. Только тогда мы брали не газообразный хлор, а его раствор в воде - хлорную воду. Ее легко приготовить. Погрузим трубку, отводящую газ из колбы, в сосуд с холодной водой, например, в перевернутую реторту (рис. 20). Желтоватые пузырьки газа исчезают, не дойдя до поверхности воды: газ успевает раньше раствориться.
Рис. 20. Получение хлорной воды Хлорная вода белит не хуже хлора (повторите опыт обесцвечивания цветов и красок); однако, в заводской практике для беления не всегда можно пользоваться газообразным хлором или его водяным раствором. Чаще для беления, а также для дезинфекции хлор берут в виде хлорной извести. В ней он связан химически, но связь эта непрочна, хлор из нее легко выделяется; оттого-то белильная известь и имеет его запах. Хлорную известь можно достать готовой; поэтому для химических фокусов, основанных на обесцвечивании хлором, вам нет надобности самим ее готовить, как мы это делаем сейчас, а можно заменить ее водой, настоенной на белильной извести. Кстати, ее белящее действие вдвое сильнее, чем у газообразного хлора. Курьез заключается в том, что хлор не сам белит краски, - их обесцвечивает кислород, выделению которого в свободном состоянии способствует хлор. Сам же хлор является сильным разрушителем волокон пряжи и тканей. Оттого-то на предприятиях отбеленные хлором изделия отмываются раствором антихлора, то-есть гипосульфита, как мы уже о том говорили. Вы заметили, как желтеют листы очень старых газет, какой ломкой становится бумага, на которой они напечатаны? Это результат отбелки хлором бумажной массы. Окраска хлором в синий цвет Хлором можно не только белить, но и красить. При помощи хлора бесцветное можно сделать цветным. В пробирке, которую я держу в руке, бесцветный жидкий клейстер. Опускаю в пробирку газоотводную трубку от прибора для получения хлора, - газ проходит через раствор, но не поднимается выше его уровня, раствор же, как видите, приобретает красивый фиолетово-синий цвет. Клейстер был мною сварен из крахмала в растворе йодистого калия. Из этого последнего хлор вытеснил йод[11], который с крахмалом дает темно-синее окрашивание. Попутно замечу, что это очень чувствительная реакция на крахмал, и (в упрощенном виде, когда берется прямо готовый йод) служит она для нахождения крахмала в качестве подмеси к творогу, какао, колбасам и пр. Не забудьте об этой реакции: она еще послужит нам для одной химической шутки за чайным столом. Окраска хлором в красный цвет Многие, даже красильные мастера, вообще не слыхали, что хлором можно красить, но изучавшие химию знают, что он выделяет йод из соединений последнего и что йод окрашивает крахмал в синий цвет. Но даже и они не все знакомы с фактом, что хлором можно красить и в красный цвет. Как это делается, сейчас покажу. Беру один из стеклянных цилиндров с хлором и отливаю из него немного газа в другой, пустой (то-есть наполненный воздухом) цилиндр. Прикрываю последний сверху стеклом и несколько раз переворачиваю его вверх и вниз, чтобы хлор хорошенько смешался с воздухом. Обратите внимание, что хлора было взято так мало, что смесь газов осталась бесцветной. Опускаю в цилиндр влажную полоску фильтровальной бумаги и вынимаю ее оттуда окрашенной в розовый цвет. Повторяю опыт, прилив немного больше хлора, - бумажка принимает интенсивно красную окраску. Бумагу я увлажнял раствором бромистого калия (применяется как лекарство при нервных болезнях), к которому была прибавлена капля щелочного раствора, флуоресцина. Хлор вытесняет из бромистого калия бром[12], а бром превращает флуоресцин в ярко-красный эозин, органическое вещество, обладающее весьма большой красящей способностью. Эту его способность мы также используем в свое время для одного забавного химического фокуса. Описанным путем в военное время можно обнаружить следы хлора в воздухе ранее, чем он дойдет до окопов, и тем предохранить воюющих от опасности отравления, дав им время надеть предохранительные маски. Еще окраска хлором Беру пробирку и, налив ее до половины водой, растворяю в ней кристаллик зеленого хлористого железа. Слабо-зеленоватое окрашивание раствора почти совсем незаметно. Погружаю в пробирку газоотводную трубку от аппарата для добычи хлора и пропускаю некоторое время газ через раствор. Жидкость принимает красно-желтоватый цвет: хлористое железо превратилось в хлорное. Эта реакция противоположна действию водорода на хлорное железо. Хотя в данном случае кислород в реакции не участвовал, она все же относится к реакциям окисления. Говоря о восстановлении железной соли водородом, я сказал, что она поможет нам выяснить одну из тайн строения веществ. Постараюсь выполнить обещанное. Железо дает с кислородом два окисла: закись - с меньшим содержанием кислорода и окись - с большим. Присоединение к закиси кислорода будет ее окислением, отнятие его от окиси - восстановлением. С хлором железо дает тоже два соединения, соответствующие закиси и окиси. Перевод одного и другого по аналогии также называется окислением и восстановлением. Тайной же химического строения веществ является то обстоятельство, что элементы соединяются друг с другом в строго определенных весовых отношениях, и когда один из них присоединяется к другому в различных количествах, то эти количества находятся в простых кратных отношениях одно к другому. Так, в воде на одну весовую часть водорода приходится 8 весовых частей кислорода, а в перекиси водорода - 8X2, то-есть 16. Пока довольно. Мы ведь решили больше развлекаться занимательными химическими опытами, а выводы из них делать лишь попутно и в небольших "порциях". Горение без воздуха Что такое горение? В элементарных учебниках говорится, что "горение есть энергичное соединение вещества с кислородом воздуха, сопровождаемое выделением тепла и пламени". Об этом частном случае горения мы с вами поговорим особо: он очень важен в практическом отношении, но с точки зрения химика все же остается не более, как частным случаем. В дальнейшем вы увидите, что гореть вещества могут не только в воздухе, но и под водою, а сейчас я покажу вам, что горение может происходить и без кислорода. Хлор тоже может настолько энергично соединяться с некоторыми веществами, что этому соединению сопутствует выделение тепла и образование пламени. Помните, я говорил вам, что водород горит в хлоре? Дополняю, что не только водород, но и его соединения и, сверх того, некоторые металлы. Вот я зажигаю огарок свечи, надетый на проволоку, и опускаю его горящим в сосуд, наполненный хлором (рис. 21).
Рис. 21. Горение в хлоре Видите: свеча продолжает гореть. Правда, коптит вовсю, не хуже керосиновой лампы с слишком выдвинутым фитилем, и по той же причине. В коптящей лампе пламени не хватает кислорода, и часть углерода, входящая в состав керосина, не сгорая, выделяется в виде сажи. Здесь же совсем нет кислорода, а в хлоре углерод не горит; в нем сгорает только водород, находящийся в составе свечи. Зато сродство водорода и хлора так велико (смесь равных объемов этих газов взрывается даже без нагревания - на солнечном или ярком искусственном свету), что вещества, богатые водородом, сами собою загораются в хлоре. Самовоспламенение Вот еще пример ошибочной привычки обобщать незначительные данные. Мы привыкли видеть, что тела загораются, будучи зажжены каким-нибудь другим, уже горящим телом. Ставят самовар - зажигают лучинки спичкой или в огне печки; закуривают папиросу - зажигают ее о свечу или о пламя спички. При этом как-то забывают, что сама-то спичка ничем не зажигается извне, а самовозгорается от трения ее головки о бумажку на коробке, то-есть от повышения ее температуры. Не верна поговорка: "Нет дыма без огня". Мы видели, что дым и без огня бывает; а уж тем более было бы неправильно думать, что нет огня без огня. Страшные подземные пожары каменноугольных копей чаще всего возникают от самовозгорания угля. Сырое сено в копне тоже может загораться. Хлор докажет нам возможность самовозгорания некоторых веществ. Наливаю в пробирку немного скипидару, согреваю его, опустив пробирку в горячую воду, и смачиваю теплым скипидаром полоску пропускной бумаги. Бросаю ее в пробирку с хлором, - она вспыхивает и сгорает коптящим пламенем. И негорючее может гореть Удивительно виденное нами горение горючих тел без воздуха, но еще более странным кажется горение в хлоре таких веществ, которые мы вообще привыкли считать негорючими. - Горит ли медь? - Что за странный вопрос, - скажете вы, - конечно, нет! - Ну, так смотрите. Беру медную монету и тру ее о стальной напилок, чтобы получить немного меди в порошке. Работа медленная и скучная. Делаю ее на ваших глазах только для того, чтобы вы видели все приготовления. А вот тут в баночке у меня такой же мелкий порошок бронзы[13]. Для удаления следов жира и грязи я промыл порошки крепким спиртом. Беру еще очень тоненький, тоньше бумажного листа, кусочек меди. Сбрасываю с бумаги напиленные на ваших глазах медные опилки в сосуд с хлором, - они вспыхивают и сгорают яркими блестками. Понемногу ссыпаю туда же бронзовый порошок, - он также загорается сам собою и сгорает весь без остатка. В заключение опускаю в хлор медный листок; обратите внимание на зеленый цвет его пламени. Зеленая пыль, покрывшая дно сосуда, - это соединение меди с хлором, хлористая медь. Итак, негорючесть меди нами опровергнута. Дымовая завеса К числу химических "достижений" военного дела относится маскировка расположения воинских частей, сокрытие их действий от наблюдения неприятеля за дымовой завесой. Только это не дым костров и вообще не настоящий дым, образующийся при горении. И в этом случае на помощь сражающимся пришла химия. Если мы заменим в нашем предыдущем опыте медь оловом, взятым в виде станиоля (тонких оловянных листов, в какие, например, завертывают плитки шоколада), а самый газ немного подогреем, то эффект будет тот же самый - олово сгорит. Не буду делать этого опыта: у меня есть уже готовое хлорное олово. Как видите, при обыкновенной температуре это не твердое, а жидкое вещество. На один момент приоткрываю склянку, в которой оно у меня хранится. Замечаете этот густой белый дым? Это хлорное олово соединяется с парами воды, всегда присутствующими в воздухе, и дает тончайшую белую пыль. Выливая хлорное олово на землю, войска за образующейся густой белой завесой скрывались от врага. Защита недешевая! Хлорное олово - вещество дорогое, поэтому на войне стали пользоваться дымовыми завесами, получаемыми другими, тоже химическими, способами. Фейерверк в склянке Наиболее эффектным примером самовозгорания и горения в хлоре является горение в нем металлической сурьмы. Сурьма - очень хрупкий элемент, по своим химическим свойствам стоящий на границе между металлами и металлоидами. Истолченную в порошок сурьму, - а толчется она легко, - всыпаю в маленькую шаровидную колбочку и соединяю горло последней широкой резиновой трубкой с стеклянной трубкой, проходящей через пробку, которая закрывает сосуд с хлором (рис. 22).
Рис. 22. Подготовка огненного дождя Вот и все приспособление для фейерверка. Поднимаю колбу вверх и небольшими порциями пересыпаю порошок сурьмы в банку с хлором. Правда, какой красивый огненный дождь? Каждая порошинка сурьмы, раньше чем сгореть, раскаляется добела, и тысячи огненных искр наполняют банку. Повторяя описанные опыты самостоятельно, не забывайте, что хлор поддерживает только горение, но не дыхание. Берегите ваши легкие и глаза и, делая опыты в комнате, если лишены возможности работать на открытом воздухе, работайте у открытого окна или перед печной тягой. Хлор в мировой войне Вот как картинно описывает Л. Никулин газовую атаку хлором и ее убийственные последствия. "Еще было далеко до рассвета, но ветер дул с запада прямо в лицо, и это был не предутренний ветер, а знак перемены погоды. Облака стояли на западе низкой стеной, и от этого темная ночь была еще темнее. И вдруг что-то сразу задвигалось, зашевелилась, заколебалось впереди за косогором, где лежали в окопах немцы. Там пели рожки, там двигались неисчислимые людские массы. В русских окопах припали к брустверам наблюдатели. По всей линии били газовую тревогу, и дымящимися, колеблющимися желтыми языками зажигались в окопах костры. Газовый наблюдатель глядел в темноту и, сжимая зубы, бил штыком по подвешенному куску рельса. Свистели дежурные, смены выбегали из блиндажей и растекались по окопам. Плясали огромные, уродливые тени от пылающих костров. Жгли костры, чтобы дымом остановить газ. Тяжелый, уже явственный, гнилой запах газа был в предательском, ласковом ветре запада. Маски противогазов уродливыми наростами, отвратительной опухолью белели на лицах. Плясали тени костров, колыхалось пламя, но от этого еще страшнее был мрак, ночь за окопами, еще тревожней была тишина. Затем вдруг взметнулись, уходя в небо огненно-лиловыми змеями, ракеты. Небо треснуло пополам, и вдоль всего фронта, с юга на север, обрушился на русские окопы чудовищный раскаленный град. Не было слышно ни отдельных разрывов, ни привычного частого пулеметного хлопанья. Сплошной оглушающий грохот, сплошное клокотание разрывов на многие версты вдоль и в глубину фронта. Отчаянно, беспорядочно палили на второй линии русские винтовки, хотя стрелять было некуда. Впереди, в первой линии, может быть, еще были свои. Но душный рвотный, мутящий запах газов, плач и стон шли оттуда, гудела и дрожала от сумасшедшей пальбы земля, и мешался разум, пальцы судорожно нажимали курок, и руки щелкали затворами. Будто чудовищные, гигантские ковры выбивали чудовищные, гигантские руки над проклятым полем. Вой и стоны стояли над окопами. Корчась в крови и грязи, падали люди и ползли, путаясь в своих и чужих внутренностях. Едкий, ползучий, невидимый в темноте газ насыщал гипосульфит плохих противогазов, разъедал легкие, и люди бросались из окопов и бежали по изрытому воронками полю, вдруг останавливались, как вкопанные, и, настигнутые свинцом, валились лицом вниз". Это картина газовой атаки хлором из времен мировой бойни 1914-18 гг. Хлор выпускается по ветру из баллонов. При внезапной перемене направления ветра газовая волна шла обратно и отравляла тех, кто ее послал. Такие случаи бывали. Хлор теперь сравнительно "невинный" газ. К концу войны, а тем более за годы, протекшие после нее, химики империалистических стран "усовершенствовали" как взрывчатые, так и отравляющие вещества и способы действия ими. Трудно предсказать, какие газы или другие отравляющие вещества будут применяться в будущей войне, но в 1914-18 гг. для этой цели брали главным образом хлор и его производные. Еще страшный газ Из опыта мировой войны известно, что, как ни страшна газовая атака хлором, но она кажется невинной в сравнении с действием фосгена, представляющего соединение хлора с окисью углерода (хлорокисъ углерода). Газ этот бесцветен, резкого запаха в смеси с воздухом не имеет, и отравление им дает знать себя не сразу, а часов через 8, вызывая, отек легких и смерть. К нему, а впоследствии и к другим соединениям хлора, стали прибегать военные химики, когда противники обзавелись масками, парализующими действие хлора. Но "нет яда, против которого не было бы противоядия", а потому научились теперь бороться и с фосгеном и с другими, еще более страшными газами. Вот о второй-то составной части фосгена - об окиси углерода - я и хочу сказать вам несколько слов. Самое страшное в ней то, что она многим из нас грозит опасностью. Рано закрытая печь, несоблюдение осторожности при работе с простым паяльником, утюгом может повести к отравлению газом. Это так называемый "угарный газ". Угорев, не забывайте, что вернейшее предупреждение вредных последствий угара - это выйти на свежий воздух; в серьезных случаях обязательно обращаться к врачу. Мы не станем получать этот газ (он получается разложением щавелевой кислоты, но этот опыт слишком рискован), тем более не будем делать с ним опытов, а лучше прочтем, что писал о нем один ученый. "Страшный спутник наших жилищ" Так была озаглавлена большая статья об этом "домашнем яде", из которой я приведу главнейшее, что каждому следует знать об окиси углерода[14]. "... Давно известно, что примесь ее к воздуху в самых малых количествах (несколько тысячных долей объема воздуха) совершенно достаточна для того, чтобы менее чем в полчаса убить человека. И, что особенно ужасно, такой воздух, заключающий в себе смертельную дозу отравы, ничем не отличается (по внешним признакам) от чистого воздуха: окись углерода есть газ, не имеющий ни вкуса, ни цвета, ни запаха. В условиях повседневной жизни отравления, оканчивающиеся смертью, сравнительно редки; большею частью они ограничиваются сердцебиением, головной болью, тошнотой, головокружением, но еще чаще (при нескольких миллионных долях содержания окиси углерода в воздухе) тяжестью головы, апатией, дурным расположением духа, беспокойным сном... Сущность отравления окисью углерода была раскрыта знаменитым физиологом Клодом Бернаром. Благодаря ему мы знаем, что окись углерода, приходя в соприкосновение с кровью в наших дыхательных путях, полностью поступает в красные кровяные шарики и соединяется в них с гемоглобином (красящим веществом шариков). Так как соединение гемоглобина с окисью углерода более прочно, чем с кислородом, то окисление крови делается невозможным. Само собою разумеется, что долго и в сколько-нибудь значительных размерах такое явление продолжаться не может, - наступает асфиксия (удушение), за которой следует вскоре смерть". Прервем рассказ Чернышева. Ужасная драма разыгралась 30 мая 1917 г. при взятии Карнилье. Французы наступали, чтоб захватить господствующую возвышенность. Перед их атакой велась адская канонада: артиллерийская подготовка к атаке. Когда высота была французами занята, обнаружился один из результатов этой подготовки. Один из французских снарядов попал в воздушный канал туннеля, выходы из которого были засыпаны осколками скал, разрушенных другими снарядами. Снаряд, попавший в воздушный канал, отравил окисью углерода два батальона немцев, спрятавшихся в туннеле и готовившихся к контратаке. Их трупы вплотную забили выходы из туннеля. Вернемся снова к тому, что говорит Чернышев. "Но и во всех тех случаях, когда мы вдыхаем ничтожнейшие количества окиси углерода, эта последняя делает понемногу свое губительное дело - уничтожает жизнедеятельность некоторой части кровяных шариков. Это ведет к расстройству отправлений организма во всех областях его деятельности: мускулы слабеют и делаются неспособными к обычной работе, пищеварение становится неправильным, сердце судорожно сжимается, нервы расстраиваются, голова (мозг) тяжелеет и теряет способность соображать привычным образом, память изменяет на каждом шагу (например, в именах окружающих лиц). Такова ужасная картина единичного легкого отравления окисью углерода. Но и это еще не все. Из воздуха и с пищей, как известно, в наш организм постоянно попадают всевозможные болезнетворные микробы, с которыми сейчас же вступают в ожесточенную борьбу белые кровяные тельца. Недостаток жизнедеятельных кровяных телец обеспечит перевес в этой борьбе за микробами. Таковы микро-причины и макро-следствия. Жаровня с горящими угольями в комнате с закрытыми дверями и окнами - хорошо известное и бесспорное средство, которым часто пользуются романисты в повестях с трагической развязкой. Но повествователи большей частью бывают плохими химиками; вероятно, поэтому они умалчивают, как образуется смертоносный яд в жаровне с угольями. Не менее интересен такой, никем не подозреваемый, источник угара, как сплошной чугунный утюг, нагреваемый на плите или прямо в топке и внесенный в другое помещение для глажения: в невидимых порах чугуна заключается большой запас окиси углерода, которая выделяется наружу по мере остывания утюга. Гладильщица, наклоняющаяся над утюгом, может угореть таким образом даже на открытом воздухе, без кусочка горящего угля поблизости. Курящаяся папироса или трубка также есть идеальный источник окиси углерода: при ее тлении очень мало образуется углекислоты. Вместе с окисью углерода в наши легкие поступает никотин и другие продукты горения и разложения табака; о вреде их мы говорить не будем - достаточно одной окиси углерода, чтобы понять, какой яд мы вводим в наш организм при курении". Автомашины с двигателями внутреннего сгорания - это тоже источник окиси углерода. Она находится в выхлопных газах их моторов и отравляет уличный воздух, а в плохо вентилируемых закрытых машинах - и воздух внутри их. Это вызывает головную боль и головокружение у пассажиров. Анализ воздуха парижских улиц показал, что в нем содержится 44 части окиси углерода на 10000 объемов воздуха. Особо значительно содержание этого страшного газа в туннелях с сильным автомобильным движением. В новом Нью-Йоркском туннеле под р. Гудзоном установлен специальный контрольный аппарат, определяющий количество окиси углерода в воздухе и сигнализирующий, когда оно становится опасным. Какова именно "ядовитость" современных автомашин? - Весьма значительная. "Опыты показали, что при скорости 45 км в час автомобили различных типов выделяют от 1 (маленькие машины) до 6 куб. м (большие модели) окиси углерода в час". (Д. Партингтон: "Химия в жизни", 1935 г.) К сожалению, в широких кругах публики не подозревают, что окись углерода - "коварный газ", который нельзя обнаружить обонянием. Ошибаются, говоря, что самовар "пахнет угаром". Пахнут в этом случае сравнительно безвредные продукты сухой перегонки угля, присутствие которых, правда, служит косвенным указанием на наличие страшной окиси углерода. Хуже всего убеждение большинства, что, если "угаром не пахнет", значит и опасности никакой нет. И опять-таки, к сожалению, мало кто знаком с прекрасным способом обнаружения присутствия окиси углерода в воздухе в самых ничтожных дозах. Этот способ заключается в следующем: надо внести в помещение, в котором подозревают наличие угарного газа, пропускную бумагу, смоченную раствором хлористого палладия. От малейших, следов окиси углерода бумажка почернеет. Для установления диагноза, отравлен ли человек угарным газом, химия дает также способ: несколько капель раствора медного купороса, прибавленные к разбавленной водой крови здорового человека, меняют окраску последней на желто-зеленую; кровь же угоревшего человека остается ярко-красной. В промышленных предприятиях, где приходится сталкиваться с опасностью отравления СО (окись углерода), устанавливаются специальные сигнализирующие приборы - газоанализаторы. Эти приборы бывают физическими, химическими и электрическими. Современная техника сумела однако этот страшный газ применить с пользой для дела. Голубой и водяной газы Надо отдать справедливость техникам, что они чрезвычайно любят придумывать совершенно неудачные названия, ставящие в тупик непосвященных. Химия не знает голубого газа. Так прозвали американские техники получаемую умышленно в больших количествах окись углерода, потому что этот газ горит голубым пламенем. Вы сами, вероятно, не раз любовались его голубыми огоньками, глядя в горящую печь. Получают его сожжением дешевых сортов топлива, не развивающих при сгорании большого жара. Горящий газ направляют навстречу току искусственно нагретого воздуха, смесь вспыхивает и сгорает в конечный продукт окисления углерода - в угольный ангидрид (углекислый газ). Температура такого пламени доходит до 1000°, и оно применяется там, где требуется не только большое количество тепла, но и сильный жар: в металлургии, в стеклянном производстве, для движения и освещения. Филологический курьез. В технике применяется еще один газ с содержанием до 25% голубого газа, то-есть окиси углерода, и называется он блаугаз. По-немецки слово blau значит синий. Но правильное его название: газ инженера Блау, по фамилии лица, предложившего его применение, а не "синий газ". Таким газом, между прочим, питаются моторы дирижабля "Цеппелин-127". Что касается водяного газа, то физик и химик назовут водяным газом, т. е. водой в газообразном состоянии, водяной пар, перегретый до такой температуры (свыше 1000°), при которой его никаким давлением нельзя сгустить в жидкость. В технике же называют "водяным газом" горячую смесь окиси углерода с водородом, получающуюся при разложении раскаленным углем воды, пульверизируемой на его поверхность в виде пыли или пускаемой в виде струи пара. Уголь при этом соединяется с кислородом воды в окись углерода, а водород освобождается. В избытке воздуха такая смесь газов сгорает, при чем окись углерода обращается в неспособный к дальнейшему горению угольный ангидрид, а водород - обратно в воду. Сказанное попутно объясняет нам, почему в кузницах, чтобы усилить жар, брызжут в уголь воду, и отчего гашение большого пожара тонкими струйками воды из ручных пожарных насосов не только не гасит, но и усиливает пламя. Газы дыхания и горения Один английский химик сказал, что поэт, впервые уподобивший жизнь горению свечи, был ближе к истине, чем сам это думал. Зажжем свечу. Коснемся ее пламени холодным утюгом. На нем, как и при прикосновении к пламени водорода, мы заметим капли воды, но, кроме того, еще и сажу. Поставим огарок свечи в высокий стеклянный цилиндр (хотя бы в банку из-под варенья). Погорев некоторое время, свеча погаснет. Вольем в сосуд известковой воды, - вода помутнеет. Подышим на холодное стекло, - оно "запотеет", покроется мелкими каплями воды. Будем дышать через налитую в стакан прозрачную известковую воду, опустив в нее один конец стеклянной трубки, а другой держа во рту (рис. 23). Вдыхайте при этом воздух носом и, задержав его в легких секунд на пять, выдыхайте ртом через трубочку: вода опять-таки помутнеет.
Рис. 23. Мы выдыхаем угольный газ Помутнение в обоих случаях зависит от одной и той же причины: от наличия соединения углерода с кислородом. Это угольный газ, или более научно - угольный ангидрид. С водой он дает слабую угольную кислоту, но зачастую даже в учебниках химии и самый газ называют углекислым газом, а то и прямо углекислотой. Следовательно, как при горении, так и при дыхании выделяются одни и те же продукты: вода и угольный ангидрид. Если бы мы в первом опыте, с которого начались наши беседы, вместо магния взяли ядовитый фосфор[15], то опыт показал бы нам, что только пятая часть воздуха, - кислород, в нем растворенный,- поддерживает горение. Если бы мы имели жестокость поместить под стеклянный колокол, погруженный краями в воду, какую-нибудь живую тварь, она бы задохнулась раньше, чем вода поднялась бы в колоколе. Почему же? Химический парадокс: являясь сильным ядом в чистом виде, фосфор в его соединениях - необходимая составная часть нашей пищи. Выделив из человеческого организма весь находящийся в нем фосфор в виде желтого фосфора, можно отравить им смертельно 250.000 человек. Потому что фосфор, жадно соединяющийся с кислородом, перестанет гореть только тогда, когда сожжет весь кислород (то-есть израсходует его на сожжение), а живое существо умрет уже при недостатке последнего. Должен оговориться: не всякое живое существо. Есть бактерии, дышащие серой; есть живые существа, для которых кислород - яд. Кислород был впервые получен в чистом виде знаменитым английским ученым Пристлеем в 1774 году. Имя Пристлея надо присоединить к списку тех многих ученых, которых преследовали попы и контрреволюционеры. Он не скрывал ни своих свободных взглядов на догматы церковников, ни революционных симпатий. И вот, когда он с друзьями праздновал годовщину взятия Бастилии, натравленные попами черносотенцы напали на его дом, разгромили лабораторию, сожгли его рукописи. Спасая свою жизнь, Пристлей бежал, а впоследствии эмигрировал в Америку. Такое преследование научной мысли происходит и в наше "просвещенное время". На наших глазах в фашистской Германии идет озверелое гонение на ученых, и сжигаются, как в средние века, на площадях труды гениальных мыслителей. Сотни ученых вынуждены были бежать из Германии, в том числе и Габер, открывший способ использования азота воздуха для синтеза аммиака и оказавший этим колоссальные услуги Германии во время мировой войны. Реакции экзо- и эндотермические При взрыве водорода с кислородом образуется вода и освобождается энергия. Чтобы разложить воду на водород и кислород, надо, наоборот, затратить энергию. Реакции, сопровождающиеся выделением энергии, называются экзотермическими, реакции, требующие притока энергии извне, называются эндотермическими. Если вещества соединяются с выделением энергии, то на разложение на них полученного соединения надо затратить такое же количество энергии, какое выделилось, когда они соединялись. И, обратно, если вещества соединяются, поглощая энергию, то при разложении они столько же ее выделяют. Отсюда важный практический вывод: многие реакции в общежитии и технике проделываются не для получения новых видов веществ, а для использования энергии, выделяющейся при реакциях. Печи топят, сжигая горючее, не для того, чтобы превратить входящий в его состав углерод в угольный ангидрид, а водород в пары воды, а для того, чтобы использовать тепло, возникающее вследствие этих реакций. В гальванических элементах цинк растворяют в кислоте не для получения цинковой соли, а для использования возникающего при этой реакции электрического тока. Химические процессы в технике используют, значит, не только для производства тех или иных веществ, но и для получения света (зажигание спички, горение свечи и керосиновой лампы), тепла (сожжение топлива в печах), механической энергии (взрывы смеси газов в двигателях внутреннего горения), электричества (в гальванических элементах и аккумуляторах) и т.д. Газ, в котором горит железо Если бы воздух не содержал азота, а целиком состоял из кислорода, жизнь организмов развилась бы, конечно, приспособившись к дыханию чистым кислородом. Одним был бы опасен такой состав атмосферы: горючестью в ней большинства окружающих нас предметов. Страшны и сейчас пожары в деревнях и городах с преобладанием деревянных строений, но во много раз больше была бы опасность, если бы воздух не состоял на 4/5 из азота, не поддерживающего горения. В нем тогда горели бы не только уголь и дерево, но и большинство металлов. Сгорели бы легко не одни деревянные избы и дома, но и железные мосты, и рельсы, и гигантские морские суда. Чтобы показать примеры горючести в чистом кислороде веществ, не горящих или только тлеющих в воздухе, добудем немного этого газа. Есть много способов выделить его в чистом виде. В технике он получается сгущением воздуха сильным давлением до 200 атмосфер и охлаждением (до - 180°). При испарении такого жидкого воздуха из него раньше всего выкипает азот. Оставшийся кислород представляет собою сильно магнитную жидкость красивого синего цвета. Применяется он для автогенной сварки и резки металлов: сжигая в особых горелках водород в струе чистого кислорода, получают длинное и острое пламя, имеющее температуру в 2000°. Стальное изделие пронизывается им насквозь раньше, чем вся масса металла успеет заметно нагреться; толстые листы котельного железа режутся, как масло ножом.
Рис. 24. Резка металла автогеном Получают кислород и иначе. Так, окись бария[16] при нагревании присоединяет к себе кислород, обращаясь в перекись бария, а эта последняя при более сильном накаливании вновь его выделяет. В последние годы кислород из воздуха получают подобным способом, только вместо окиси бария пользуются другим, более сложным по составу веществом. В учебниках химии обычно указывают на получение кислорода разложением окиси ртути или смеси хлорноватокалиевой соли (бертолетовой) и перекиси марганца (пиролюзита). Первый способ пригоден для получения очень незначительных количеств газа, второй не безопасен, и оба требуют сильного нагревания. Лучше всего иллюстрировать опасность бертолетовой соли, этого невинного лекарства для полоскания горла[17], такой картинкой: "Случай выделения наибольшего количества кислорода, какое только нам известно, произошел 12 мая 1899 г. на химическом заводе в Сент-Геленсе благодаря тому, что бертолетовая соль случайно слишком нагрелась. Около 150 тонн приготовленной соли, упакованной в бочках, находились на складе в ожидании отправки. Каким-то образом искра от бочки, которую вкатывали в помещение, где кристаллизуется соль, попала в деревянную раму кристаллизационного чана. Дерево это, будучи пропитано бертолетовой солью, было в высокой степени способно к воспламенению. И действительно, вспыхнул страшный огонь, который поднялся вверх, и через несколько минут крыша здания была охвачена пламенем. Тут произошла страшная сцена: невероятный жар, накаляя ряд за рядом тесно сложенные бочки с бертолетовой солью, вызвал выделение огромного количества чистого кислородного газа, который расходился во все стороны. Все деревянные постройки, погруженные таким образом в атмосферу чистого кислорода, горели со страшной силой, так что вскоре все здание раскалилось добела, горя с ослепительным блеском, как в плавильной печи. Наконец, когда кислород не мог уже более достаточно быстро выделяться из боченков, соль взорвалась. И что за взрыв!.. Два громадных удара, быстро последовавших один за другим, возвестили городу о случившемся несчастии, а клубы черного дыма, поднявшиеся в виде гигантского столба, указывали место взрыва. Весь завод разлетелся вдребезги. Здания и склады сравнялись с землей. Большие передвижные подъемные краны сгорели, как спички. Вершина соседнего газгольдера[18] была разорвана в куски, и около 1/4 миллиона куб. футов пылающего газа взлетело в воздух. Летящие и горящие головни распространяли пожар, который представлял поразительное зрелище огромного столба пламени, со страшным ревом поднимающегося на 500-600 футов в высоту. Удар был столь страшный, что земля заколебалась, как при землетрясении. Дома были снесены, как ветром; на целые мили все стекла были разбиты вдребезги гигантской воздушной волной, тогда как весь город был объят паникой. Пассажиры поезда, который только что подошел к станции, подверглись страшному испытанию: хотя станция находилась далеко от места взрыва, вагоны подпрыгнули на месте, и все стекла были разбиты как будто кем-то нарочно и сразу. Вероятно, около полутора миллионов куб. футов кислородного газа таким образом сразу вылилось в воздух. Эта катастрофа была простым повторением, только в огромных размерах, одного из приключений, которые происходят со всяким, начинающим практически изучать химию, именно при приготовлении кислорода нагреванием бертолетовой соли"[19]. Не правда ли, лучше кислород добывать как-нибудь иначе, безопаснее? Да! И я советую получить его действием марганцево-кислого калия на перекись водорода.
Рис. 25. Добывание кислорода То и другое легко достать в любой аптеке. Крепкий раствор перекиси водорода влейте в колбу с воронкой или двугорлую склянку, всыпьте туда же марганцево-кислого калия и собирайте выделяющийся кислород в цилиндры или бутылки, наполненные водой и опрокинутые отверстием вниз, в пневматическую ванну (рис. 25), - словом, так, как собирали водород. Только, вынимая из ванны сосуды с газом, ставьте их отверстием вверх, прикрывая матовой стеклянной пластинкой, потому что кислород немного тяжелее воздуха. Горящее железо Обернув вокруг карандаша тонкую отожженную железную проволоку, насаживают на ее конец кусочек пробки, зажигают последнюю и опускают проволоку в сосуд с кислородом. Можно прямо вколоть свободный конец проволоки в мягкую пробку и закрыть ею склянку с газом. На дне склянки надо оставить немного воды, то-есть, собирая в нее выделяющийся кислород, не вытеснять им из сосуда всю воду. В этом случае окалина (продукты горения железа), получающаяся при сгорании железа, остывает в воде, а иначе дно склянки может лопнуть (рис. 26).
Рис. 26. Горение железа в кислороде Наберите кислорода в бутыль из темно-зеленого стекла и зажгите в нем ленточку магния (через белое стекло свет будет так ярок, что может повредить глазам). Влейте в сосуд воды, хорошенько взболтайте с образовавшимся порошком окиси магния и через некоторое время попробуйте, как говорят химики, реакцию жидкости. Несмотря на ничтожную растворимость окиси магния в воде (с образованием гидрата окиси), реакция будет слабощелочная. Лакмусовая бумажка окрасится в синеватый цвет. Это показывает, до чего чуток лакмус к кислотам и щелочам, так как одна весовая часть окиси магния растворяется только в 55.000 частей воды. Подумайте, как же, значит, ничтожно ее количество в том объеме воды, который находится на дне вашей склянки! Ошибка Жюля Верна В романе Жюля Верна "Таинственный остров" есть такие строки: "Затем руда и уголь были размещены чередующимися слоями - слой руды на слое угля и т. д. Теперь, после того как уголь будет зажжен и в кучу станут нагнетать воздух мехами, в ней должны произойти следующие химические процессы: под влиянием обильного притока кислорода воздуха уголь, сгорая, превращается в углекислоту. Углекислота же, воздействуя на руду окиси железа, отнимает от нее частицу кислорода и таким образом выделяет из нее чистое железо". Ошибся на этот раз Жюль-Верн! Углекислота, правильнее - угольный ангидрид - предельное соединение углерода с кислородом. Оно от окиси железа отнять кислород не может. В действительности при неполном сгорании углерода образуется окись углерода, которая и отнимает от руды кислород, превращаясь в угольный ангидрид. Выделяющееся железо не чисто, оно содержит примесь углерода. Живые мертвецы Гораздо легче окрасится лакмусовая бумага в синий цвет, если повторить последний опыт, заменив магний калием или натрием. Это очень легкие (легче воды) серебристобелые в свежем разрезе, мягкие как воск металлы, которые, подобно кальцию, приходится хранить в керосине. Они также выделяют из воды водород, но эта реакция идет у них еще энергичнее, сопровождаясь таким нагреванием, что выделяющийся газ загорается, а с ним вместе начинают гореть и сами металлы. Мы не станем проделывать этот опыт и вам не порекомендуем, - он зачастую сопровождается небольшим взрывом, который опасен тем, что едкая жидкость может брызнуть в глаза и причинить непоправимое несчастье. Я сейчас хочу показать другой опыт. Осторожно, не касаясь натрия руками, вынув его пинцетом из баночки, отделяю ножом кусочек величиной в мелкую горошину, удаляю с него керосин пропускной бумагой, кладу металл в железную ложечку, нагревая в пламени спиртовой лампочки. Натрий загорелся, и я опускаю его в цилиндр с кислородом[20] (рис. 27). Металл горит ярким пламенем.
Рис. 27. Горение натрия Взгляните на мое лицо, посмотрите друг на друга. Какие у всех нас страшные, темные лица "мертвецов". Оглянитесь вокруг. Куда делись яркие краски обстановки? Как бедна окраска всех окружающих нас предметов! Таково действие лучей горящего натрия. Я обещал вам сказать, что такое основания. Начать с того, что слово это является примером многих слов, переживших свое значение. До Лавуазье, выяснившего различие между сложными и простыми веществами, в науке господствовала удивительная гипотеза флогистона, таинственного флюида (истечения), менявшего свойства тел и их тепловое равновесие. Металлы считались соединением землистых веществ, из которых они выплавляются, с флогистоном. Самые вещества эти принимались за простые тела, "основания" металлов. В действительности это были окислы их, продукты соединения металлов с кислородом. Когда защитникам флогистона указывали на факты, противоречащие их гипотезе, они отвечали: "тем хуже для фактов", а на замечание, что руда всегда весит больше, чем выплавляемый из нее металл, говорили: "значит, флогистон имеет отрицательный вес". Мы называем основаниями кислородные соединения металлов, дающие с кислотами соли. Не все металлические руды - окислы, и не все окислы металлов - основания. Один и тот же элемент, в зависимости от степени окисления, может давать окислы и основного и кислотного характера. Так, мы еще встретимся в наших дальнейших опытах с солями железа, в которые этот элемент входит и как металл, и как металлоид. Наиболее резко выраженными основаниями являются окислы щелочных металлов и нашатырный спирт. Последний, как вы знаете, представляет раствор аммиака в воде, а аммиак (мы еще познакомимся с ним поближе) - это газ, состоящий из азота и водорода. Только самые новейшие исследования над строением атомов указывают на совершенно иные определения понятий оснований и кислот, чем принятые в наших учебниках, но здесь не место о них говорить. Кстати, о словах и понятиях. Слово "кислород" тоже не из самых удачных, так как хотя окислы металлоидов и дают, растворяясь в воде, кислоты, но кислоты, да еще такие сильные, как соляная, могут и не содержать в себе кислорода. Любопытная деталь. Латинское название соляной кислоты - acidum muriaticum. Хлор, в ней заключающийся, считали окислом неизвестного элемента мурия, не желая верить, что может существовать кислота, не содержащая кислорода... Химия неба Помните - в самом начале книги я сказал о химии, что "она научила нас познавать состав небесных тел и даже определять их возраст"? Это было сказано не ради красного словца. Ученые, действительно, нашли способ узнавать, какие элементы входят в состав небесных тел, а по составу могут судить и об их возрасте. Началось это с изучения света, излучаемого горящим натрием. Раскаленное добела твердое тело дает при разложении его лучей призмой сплошной семицветный спектр. Если пропустить эти лучи через пары натрия, то спектр оказывается как бы перерезанным несколькими черными линиями. Наиболее заметная, характерная для натрия линия перерезывает желтую часть спектра как раз там, где сам горящий натрий, бросающий лучи света через спектроскоп, дал бы ярко-желтую черту. Пламя каждого элемента дает не сплошной спектр, а прерывистый, состоящий из отдельных цветных полос. Внимательно рассматривая спектр Солнца, растянутый в длину, нашли в нем темные линии (фраунгоферовы линии), совершенно точно совпадающие с линиями, свойственными натрию. Что же это может означать другое, как не то, что в солнечной сфере находятся пары натрия? В дальнейшем, сначала в спектре Солнца, а затем и других звезд, были найдены линии, характерные для других земных элементов. Но в их спектрах имеется немало и таких линий, которые не соответствуют известным нам веществам. Часть их ученые даже окрестили заочно и по месту линий в спектре определили приблизительный характер этих внеземных элементов. Таковы: гелий, короний, небулий[21] и другие. Прекрасным доказательством, что такое определение веществ, находящихся от нас на головокружительных расстояниях в миллиарды миллиардов километров, не простая фантазия, а величайшее достижение человеческой мысли, служит история открытия гелия. После того как он был найден спектроскопом на Солнце, его удалось найти и на Земле. Иначе сказать, когда некий новый элемент был найден в земных минералах, его спектральные линии с точностью совпали с линиями гелия. Значит, это и был гелий! Найден он и в водах некоторых источников, например, у нас на Кавказе и в Поволжьи, и в количествах 0,000001-0,000002 долей объема входит в состав воздуха. Небесные тела по их спектрам делятся на состоящие из водорода и других газов, - это наиболее молодые; затем заключающие в своем составе пары металлов, - группа более старая; и наконец, содержащие углерод, - самые старые. Конечно, этот "возраст звезд" зависит не только от времени, протекшего со дня их образования, но и от их размеров. Чем крупнее небесное тело, тем дольше остается оно "молодым"; чем меньше его масса, тем ранее оно успевает "состариться". Эти же наблюдения над спектрами звезд, а, следовательно, над их составом, показывают нам, что 92 известных нам элемента не представляют соответственного количества абсолютно неизменяемых первичных форм материи. С течением времени, измеряемого, быть может, миллионами наших земных лет, "водородные" звезды превращаются в звезды "металлические". Откуда же берутся в них эти металлы? Когда-нибудь астрономия, физика и химия совместно решат нам и эту задачу, и мы разгадаем тайну образования элементов, как уже начали разгадывать тайну их строения. Смещение спектральных линий элементов, наблюдаемое при изучении спектров так называемых "неподвижных" звезд, к красной или фиолетовой части спектра указывает на направление их движения - к нам или от нас. Величина же этого смещения позволяет определить скорость движения звезды. Вот к каким удивительным следствиям привел ученых простенький опыт горения натрия, который мы с вами проделали. Удивительная наука химия! Куда делся кусочек угля? Опустим в сосуд с кислородом на железной ложечке кусочек раскаленного докрасна угля. Он вспыхнет и сгорит без остатка ярким пламенем. Ни дыма, ни твердой окиси, как после горения металлов, в сосуде не останется. Уничтожение материи?.. Нет! Лавуазье более ста лет тому назад доказал, что вещество не уничтожается никакими реакциями, что меняются только его свойства. Можно проделать этот опыт, помещая герметически закрытый сосуд с кислородом на чашку весов. До и после сожжения в нем угля вес его остается тот же. Сгорая, уголь соединился с кислородом и образовал невидимый углекислый газ. Его присутствие можно обнаружить, переливая газ в сосуд с горящими огарками (рис. 28). По мере того как сосуд наполняется угольным ангидридом, огарки гаснут один за другим, начиная от самого маленького и кончая самым высоким.
Рис. 28. Угольный газ гасит пламя свечи Мы также уже знаем, что от этого газа мутнеет известковая вода[22]. Почему? Потому что газ, соединяясь с известью (гидратом окиси кальция), дает нерастворимую в воде углекислую известь. Мы видели, что такое же помутнение известковой воды происходит, если продувать через нее воздух, выдыхаемый нашими легкими. Вы представляете себе все то количество угля, которое почти 2 миллиарда людей, обитающих на Земле, ежегодно выдыхают в виде угольного газа? Вероятно - нет. Ну, так я скажу вам, что оно равно 156 миллиардам килограммов угля, который, будучи собран воедино, образовал бы куб с ребром более чем в 440 метров! (рис. 29).
Рис. 29. Сколько угля выдыхает ежегодно все человечество "А ведь это не менее, чем 1/7 всей годовой мировой добычи угля, который мы также обращаем в углекислый газ, сжигая в заводских и домашних печах и, следовательно, вводя его состав атмосферы. А каковы заводские печи в наше время, видно из того, что домны Магнитогорска расходуют столько же воздуха, сколько вдыхают его все жители Ленинграда. Добавьте сюда газ, выдыхаемый всеми другими живыми существами всего света. А его истечение из земли! В 1783 г., при извержении угольного ангидрида одним из вулканов Исландии, газом было задушено 9.000 человек и 239.000 голов домашнего скота. Из почвы он выделяется почти повсеместно; от него чаще всего задыхаются рабочие, спускаясь в глубокие колодцы и погреба. Свеча, опущенная в такое скопление газа, гаснет. Угольный ангидрид не так ядовит, как хлор или окись углерода, но все же в больших дозах парализует головной и спинной мозг. Попутно интересное замечание: земля дышит. Дышит, как живые существа, воспринимающие кислород всей поверхностью своего тела и через нее удаляющие угольный ангидрид. Но на ряду с процессами выделения углекислого газа в природе идет непрерывный процесс его разложения. Освещенные солнцем зеленые части растений поглощают из воздуха угольный газ и выделяют в него обратно кислород. Они питаются этим газом, как мы питаемся ими самими и трупами животных. Затем воды морей и океанов ежегодно растворяют в себе большие количества угольного ангидрида, не насыщаясь им, так как мириады живущих в глубине их вод организмов поглощают этот газ, вводя его в состав своих панцирей. Мел и известняк образовались из остатков несметного числа таких некогда живших организмов и продолжают и поныне образовываться на дне океанов. Проходят миллионы лет, - миг в жизни земного шара, - и там, где бушевали морские волны, возникает суша и выносит на поверхность известковые отложения океанов. Прообразующие процессы сжатием и повышением температуры превращают их строение в кристаллическое. Мрамор, из которого была изваяна Венера Милосская, был некогда известковым панцирем морских фораминифер (микроскопических корненожек)... Из этих-то соединений углекислый газ, пребывавший в них связанным со времени, предшествовавшего появлению на Земле первого человека, и будет сейчас мною выделен. Примечания:1 Настоятельно советую с этим дополнением ознакомиться раньше, чем приступать к опытам, описанным в книге. 2 Если, конечно, иметь в виду так наз. химически чистое железо, потому что технически применимое железо по составу далеко не просто. 10 Перекись марганца можно заменить марганцево-калиевой солью; тогда и нагревать не нужно. 11 Йод - элемент группы хлора, твердое тело; его спиртовой раствор - обычное средство лечения порезов, опухолей и др. 12 Бром - элемент группы хлора, красно-бурая, дурно-пахнущая жидкость. Вся эта группа элементов с водородом дает кислоты, не содержащие кислорода (например, соляная кислота). 13 Бронза - сплав меди с оловом, свинцом или алюминием. 14 К. А. Чернышев, "Физик-любитель", т. II, № 6-7. 15 Фосфор известен в двух видах: желтый - огнеопасен, светится в темноте и весьма ядовит. Из него нагреванием без доступа воздуха получают безопасный красный фосфор. 16 Металл, по своим химическим свойством сходный с кальцием. 17 Впрочем, для этой цели врачи теперь перестали ее прописывать 18 Газохранилище 19 Д. Мартин, "Чудеса и завоевания химии". 20 Чтобы окись натрия не рассеивалась в воздухе комнаты, цилиндр надо прикрыть стеклом, а после того, как горение окончится, влить немного воды и взболтать. Образовавшийся едкий натр окрашивает лакмус в синий цвет. 21 В последнее время, впрочем, доказано, что линии, приписывавшиеся гипотетическому небулию, в действительности соответствуют наличию на Солнце азота и кислорода в особых состояниях их атомов. 22 Известковую воду можно купить готовой в аптеке, - она применяется в медицине, - но нетрудно изготовить и самому. Надо настоять свежеприготовленную гашеную известь, слить в нее раствор, профильтровать его и наполнить им скляночку до самой пробки; тогда, будучи плотно закупоренной, известковая вода не мутнеет при хранении. Если же ее оставить надолго в соприкосновении с воздухом, она замутится, так как следы угольного ангидрида в воздухе, тем более комнатном, всегда имеются. |
|
||
|
Главная | Контакты | Нашёл ошибку | Прислать материал | Добавить в избранное |
||||
|
|
||||